为继续落实“我为群众办实事”要求,做好《保健食品原料目录 大豆分离蛋白》《保健食品原料目录 乳清蛋白》相关配套技术要求和解读工作,2023年10月10日,国家市场监督管理总局食品审评中心举办了大豆分离蛋白等原料产品备案宣贯会,会议由中国营养保健食品协会协助组织。国家市场监督管理总局特殊食品安全监督管理司保健食品注册处处长宛超,国家市场监督管理总局食品审评中心保健食品安全审评部副主任萨翼,中国营养保健食品协会执行副会长厉梁秋、秘书长张中朋及近2000位代表通过线上线下方式参加了会议。

萨翼副主任围绕近期发布实施的《保健食品原料目录 营养素补充剂(2023年版)》及解读文件、《允许保健食品声称的保健功能目录 营养素补充剂(2023年版)》、《保健食品原料目录 大豆分离蛋白》、《保健食品原料目录 乳清蛋白》及解读文件和《保健食品原料 大豆分离蛋白 乳清蛋白备案产品剂型及技术要求》进行了宣贯暨培训。
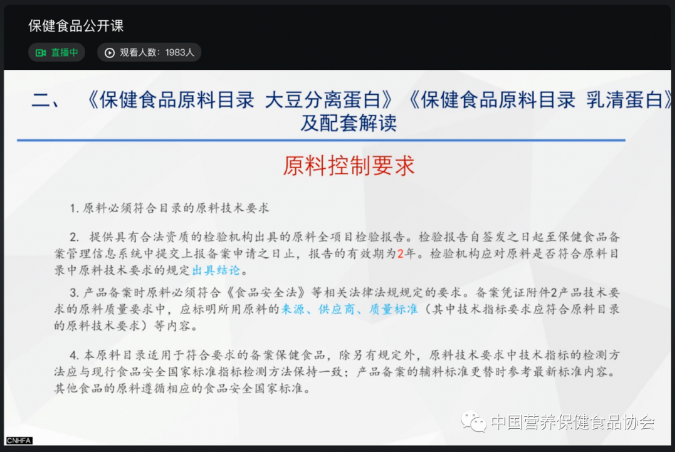
萨翼副主任首先对文件背景及行业关注点进行了贯宣,并着重对营养素补充剂中的酪蛋白磷酸肽+钙、DHA藻油问题,大豆分离蛋白、乳清蛋白中的适宜人群、保健功能、配方配伍、产品名称、注册转备案管理、产品剂型及技术要求等问题进行了详细介绍。

同时为帮助与会代表正确理解法规要求,会议设置了提问环节,线下参会代表基于对法规技术文件的理解,结合企业自身情形,进行了提问,萨翼副主任进行了详细的解答。
最后,宛超处长对会议进行了总结,充分肯定了中国营养保健食品协会的桥梁作用,并强调保健食品备案是保健食品高质量发展的必要渠道及条件,同时,保健食品备案工作的发展,需要监管部门及全行业的共同努力,希望协会能够凝聚企业力量,积极对备案剂型等问题进行研究,共同推动保健食品行业的健康发展。
下一步,协会将继续发挥行业桥梁作用,持续跟进政策实施和行业发展情况,收集梳理企业共性问题,组织开展专题研究,形成行业共识或行业方案,上报给食品审评中心和特殊食品司参考。并根据实际情况,适时组织开展政策贯宣和行业交流活动。
关于保健食品备案相关问题,会员企业可梳理并反馈至协会法规邮箱:regulation@cnhfa.org.cn,邮件标题请标注为“保健食品备案相关问题”。
(中国营养保健食品协会网站发布信息为协会版权所有,所有转载请联系cnhfa@cnhfa.org.cn,转载请标明作者及来源。)

