
中央党校(国家行政学院)社会和生态文明教研部胡颖廉教授
摘 要:发达国家监管旨在纠正市场失灵,监管是市场的补充。“中国式”监管则是行政逻辑对市场机制的全面渗透,其基于行政主导理念、非均衡结构和单向介入行为,从培育、扭曲、庇护三个维度实现行政吸纳市场。以保健食品为焦点个案论述监管制度的内在困境。第一,专业约束下的“政府背书式”审批,事实上降低了保健食品市场准入门槛,导致产业基础系统性薄弱。第二,过度管控嵌入“碎片化”监管体制后扭曲正常市场竞争,放大了生产经营活动过程性风险。第三,监管部门将事权“剩余化”下沉基层并依赖运动整治以应对市场失灵,从而抑制产业创新并庇护低水平市场主体。作为对策,必须放权到底和管服到位,通过均衡市场和监管,实现高质量发展和重大风险防范的共赢。
关键词:政府监管;食品安全;保健食品;行政吸纳市场
一、问题提出
“保健”市场乱象是我国市场秩序和食品安全问题的顽疾,保健食品则是“保健”市场重要组成部分。由于高质量保健食品有效供给不足,近年来不少消费者到国境外抢购营养素和功能性食品。2018年末的权健事件更彰显出“保健”市场在产品质量、宣传行为和产业素质等方面深层次挑战,引发全社会焦虑。随着人口老龄化社会到来和消费全面升级,保健食品监管成为保障民生、高质量发展以及社会稳定的有机结合点1 。
尽管2018年全国保健食品监督抽检合格率高达98.3%,高于97.6%的食品安全总体抽检合格率2 ,然而违法营销宣传、欺诈销售等问题突出,一些普通食品标签虚假标识声称加剧了市场混乱。如2016年全国食药监管部门受理保健食品投诉举报26 966件,查处案件涉案总值7 866.7万元3 ,市场呈现安全但不放心的困局。面对十分严峻的形势,监管部门强调以最严要求整治“保健”市场乱象4 。那么最严监管的政策意愿在现实中能否实现?我们需要构建理论框架加以阐释。

二、文献综述和理论框架
监管(regulation)意味着政府与市场关系的基础性重构,其既不同于经济社会高度结构化于国家体系之中的全能主义5 ,也区别于政府提供大规模公共服务以干预经济社会活动的福利国家6 。成熟市场经济国家针对自由市场失灵和司法救济缺陷,逐步引入以政府干预为主的监管,引导和限制市场主体行为。中国正在经历独特的监管体制改革路径,即在市场发育整体滞后的前提下,试图直接从计划经济的行政主导和政企不分过渡到现代监管,保障市场在资源配置中发挥决定性作用。这种“制度可能性曲线”的反向运动7 ,使得政府必须在削减行政管控的过程中与市场失灵的潜在增量求得最优均衡,进而意味着政府不得不同时扮演市场促进者和市场监管者双重角色,并因此成为“中国式”监管型国家建设的逻辑起点8 。
传统监管研究更多关注能力对结果的影响9 ,受既有文献启发,本文提出“行政吸纳市场”的监管制度内涵。国内学者早期用“体制吸纳”概括公共权力对公众参与的主动吸收和信息沟通10 ,具体分为立法吸纳、组织吸纳和行政吸纳三个维度11 ,是兼具行政主导性和民意吸纳性的社会回应方式12 。而后有研究用“行政吸纳服务”解释我国国家与社会关系,认为国家占据主导性权力分配地位,社会依附于国家13 ,两者通过支持与配合机制互动融合,从而提高公共服务的质量和水平14 。与之相近的概念是“行政吸纳社会”,国家通过限制、替代、优先满足强者利益等方式,实现与社会的相互融合而非对立15 。更近一步的概念是“甄别性吸纳”,即国家以合法性偏好、功能偏好和能力偏好对社会组织进行甄别,将适宜的社会组织吸纳进合作范畴,对它们赋权增能的同时加强控制16 。
归纳而言,已有研究从价值理念、结构关系和行为模式三个层次探讨行政吸纳的内涵和逻辑。本文所称行政吸纳市场,是指行政监管对政府与市场关系的全面渗透。作为核心机制的“吸纳”包括行政主导理念、非均衡结构和单向介入行为三个路径,并且从培育、扭曲、庇护的基本向度塑造了这种关系的内在困境。行政吸纳市场是对政府与市场关系的概括,也是“中国式”监管制度面临的困境。政策实践也印证了上述理论假定。例如习近平总书记提出用“四个最严”确保人民群众“舌尖上的安全”,也就是最严谨的标准、最严格的监管、最严厉的处罚、最严肃的问责17 。上述标准、监管、处罚和问责,正是分别从市场准入门槛、事中事后监督执法、防范化解重大风险等视角对食品安全工作提出要求。在学理逻辑与政策实践基本吻合的前提下,如何理解“中国式”监管的具体特征呢?
第一,“政府背书式”审批并未有效提升市场准入门槛。改革开放初期,基于计划经济制度惯性和市场秩序乱象,监管部门构建起以硬件要素实质性审核为主要特征的行政审批制度,这在当时具有一定合理性。“政府背书式”审批包括两大要点:其一,申请人以可批和获证为目的投入大量精力准备静态申报材料,但未必真正关心自身承担的主体责任。其二,监管部门耗费大量行政资源开展资料审核、现场核查等工作,甚至出于地方政府趋利性帮助申请人材料合规,直至符合要求后发证。有限市场准入的理念使监管者将发证看作监管的主要途径18 ,然而获证并不意味着生产经营者真正具备资质且行为持续合规。受机构能力制约的监管部门不得不对严格标准进行宽松执行,因此“政府背书式”审批弱化了诚信观念和质量安全意识。随着越来越多生产经营者进入市场,各领域普遍形成多、小、散的产业结构,导致产业基础系统性薄弱。由于事中事后监管能力不足,进一步回归行政审批成为监管部门应对压力的保守策略19 。行政许可的逻辑意味着,监管专业性约束下的“政府背书式”审批,难以有效提升市场准入门槛(命题1)。
第二,过度管控难以防范过程性风险。产业基础薄弱带来普遍性违法违规行为,在源头制约产品质量安全水平。面对数量庞大的非标准化市场主体,监管部门无可避免地遭遇事中事后监督执法失灵。基于“对审批迷恋,对监管迷茫”的行为特征,为防范行业系统性风险,监管部门以传统行政思维加强管控,习惯于文件层层转发、合规要求持续强化、全覆盖式检查、选择性执法等监管机制。由于缺乏对真实风险点的准确把握,其往往不直接针对安全性事项,既消耗了大量监管行政资源,又增加了企业制度性交易成本,导致市场成本收益信号失真从而扭曲正常竞争秩序。这种过度管控降低了监管威慑力,非但未能提供守法激励,反而在特定条件下倒逼违规操作。尤其当嵌入“碎片化”监管体制时,由于各部门政策目标差异,更加难以形成风险防范的制度合力。事中事后监管的逻辑表明,过度管控可能放大市场活动的过程性风险(命题2)。
第三,监管事权“剩余化”下沉催生运动整治。面对市场失灵频发,监管部门在问责压力下倾向于将事权下放。以2018年长生疫苗案件为例,高度技术专业性的疫苗生产企业日常监管职权居然被配置在县区级20 。多级责任结构下监管力度层层衰减,加之依然存在的地方保护和企业寻租,庇护了低水平市场主体。为规避潜在问责,基层出现从邀功到避责的行为模式转变21 ,表现为监督检查留痕应付上级考核,用开会和罚款代替监督检查,特别是依靠运动整治回应社会舆论压力。这种带有形式主义色彩的举措尽管短期内遏制了问题,但未能形成提升监管效能的长效机制。与此同时,还逆向激励监管部门采取更为保守的措施,进一步放大了市场要素的错配,从而抑制了产业技术创新。在风险化解的逻辑中,监管事权“剩余化”下沉基层并依赖运动整治以应对市场失灵(命题3)。本研究将基于上述框架具体分析保健食品监管的制度困境,提出的中心命题是:在行政吸纳市场的格局中,最严监管的政策意愿会得到相反的结果。
三、我国保健食品产业和监管的历史演进
了解保健食品发展历史、产业现状和监管体系,是研究的前提。在人类所摄入的物质中,食品维持生存和提供营养,药品则用于预防、诊断和治疗疾病,两者有较为清晰的内涵和边界。根据我国监管部门定义,保健食品的用途介于食品与药品之间,一般认为是指声称具有特定保健功能或者以补充维生素、矿物质为目的的食品22 。各国对保健食品科学界定和管理制度差异巨大。仅名称而言,美国叫膳食补充剂(dietary supplement),欧盟称补充食品(food supplement),澳大利亚归类为辅助药品(complementary medicine),日本有保健功能食品(health food)。由于保健食品本质上是对人体营养缺陷的补充和机能调解,其功效因人而异,且短期内不具有明显效果。这种相对模糊的定义和认知,成为“保健”市场诸多乱象的焦点。
中国近现代保健食品产业发展始于清朝末年,当时随着西方生理学传入,宣称补脑、补血等功效的药酒、保健丸、饮料通过广告营销手段在经济发达地区盛行23 。之后,国民政府卫生署负责食品卫生管理,但由于连年战乱,监管制度建设严重滞后。如1947年中国第一部胶片广告居然宣称“青岛啤酒既可以开胃健脾,还可治疗脚气风湿肠胃病”,凸显市场上夸大宣传的状况。新中国成立后尤其是改革开放以来,人参、蜂王浆等传统滋补品受到人民群众青睐。上世纪80年代的杨振华851营养口服液开启了滋补营养品行业发展的序幕,迅速出现100余家企业生产约1 000种产品24 。卫生部于1987年10月发布实施《中药保健药品的管理规定》,明确由省级卫生部门审批“药健字”,其概念是对人体有一定程度的滋补营养、保健康复作用且长期服用对人体无害的药品。随着消费需求持续释放,产业高速增长,1995年全国有生产企业3 000余家,总产值200多亿元25 。然而发展型地方主义和监管缺位带来市场秩序混乱,媒体曝光了中华鳖精虚假宣传,红桃K、三株口服液夸大疗效的行为,消费信心受到影响,行业进入低谷期。
为加强监督管理,卫生部于1996年颁布《保健食品管理办法》,明确国家和省两级卫生行政部门负责保健食品的审批、生产经营环节的监督管理26 。2003年国务院机构改革后,产品审批职能由国家食品药品监督管理局承担。为严格规范市场准入,监管部门参照药品注册管理模式,在技术和管理两个层面构建起实质性审查制度,对保健食品按品种进行文号管理(俗称“蓝帽子”),并且不得以治疗疾病为目的,从而正式确立了“政府背书式”审批。经审批的产品意味着具有明确、稳定的保健作用,全社会对保健食品功能的认知逐步从治病转向营养,因而持续激发了产业投资热情。表1概括了改革开放40多年保健食品行政许可制度的阶段和变迁。当前我国保健食品产业全链条分为种植养殖、研发生产、经营消费三大环节,其横跨第一、第二、第三产业,涉及农业农村、市场监管、药品监管、卫生健康、商务、公安等多个政府部门,监管体系极为庞杂。加之中药类保健食品的科学性、直销和会议销售的商业伦理性等复杂因素,加大了保健食品监管的难度。
表1 改革开放以来保健食品行政许可制度演进
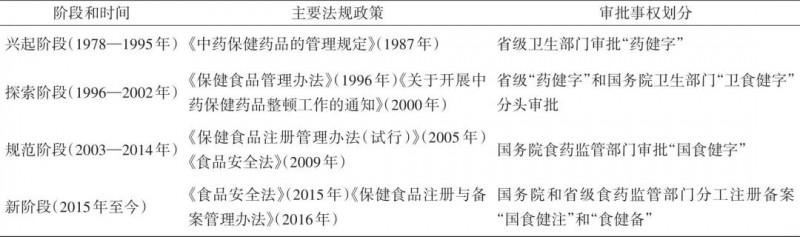
注:作者根据公开材料整理。
国内外经验表明,保健食品产业发展通常与一国经济社会水平相关联。根据美国诚信营养协会(CRN)统计,2017年美国有76%的成年人服用膳食补充剂,这一数据比2008年提高了12个百分点。而55周岁以上美国成年人中更有80%服用膳食补充剂,比例高于其他年龄段27 。我国保健食品市场也经历了与西方类似的变迁。2005年北京、上海、广州三大城市中仅三分之一消费者认为保健食品对身体有益,三分之一的受访者在保健食品上没有任何支出28 。随着人民对安全、健康等美好生活需要日益增长,保健食品市场规模持续扩大。2017年11月底,全国共有保健食品生产许可证2 317件,销售总额约4 000亿元29 ,超越美国同期430亿美元的市场规模。然而产业蓬勃发展的背后隐含着安全忧虑。美国87%的成年人对膳食补充剂的安全、质量和有效性具有信心,但中国消费者对保健品类产品的不满意率则高达28.6%,尤其在各类消费商品和服务中最为突出30 。正因此,监管保健食品的安全性和有效性,成为政府的重要职能。
四、行政吸纳市场的机理分析
基于原料和产品市场准入的制度差异,各国保健食品行政许可模式总体分为宽松准入型和严格审批型两大类,前者以美国为模板,后者以中国为代表。市场准入制度的独特性,成为分析我国保健食品监管制度的重点。
(一)行政培育市场:“政府背书式”审批的困局
“政府背书式”审批有其内在逻辑和内生困境。出于对市场失序的担忧和实践中诸多乱象,监管部门要求保健食品注册申请人开展必要的动物和人群功能试验,证明特定成分与功效之间的量效关系,其初衷是基于“成分—靶向—功效”的现代科学思维设定准入门槛,试图培育出良性市场。然而保健食品有效成分的单位剂量功效明显低于药品,申请人对基础研究和临床试验的投入力度与制药企业亦不具可比性,因此以现有科学手段难以证明量效之间关系31 。法规一方面禁止治疗疾病的功能声称,另一方面要求像药品一样证明量效关系,两者自相矛盾。加之中国特有的“药食同源”传统,中药类保健食品不同于普通营养素补充剂和功能性食品,探索因果关系的现代科学手段与崇尚实践经验的中医药文化差异显著。更为重要的是,监管机构专业能力与技术审评需求之间出现结构性差距,审评审批制度科学化和规范化建设滞后,不得不依赖申报资料的形式性审查。而长期由卫生行政部门认定检验机构的做法形成事实上的行政垄断,扭曲了正常市场竞争。围绕形式要件复杂的审批,出现了规模庞大的批文申报中介市场和企业寻租空间,权威媒体已公开报道诸多乱象,包括申报流程造假、手法偷梁换柱等32 。一位业内资深人士坦言,“(保健食品)这套市场准入制度已经完成历史使命了,现在不该这么管”33 。
监管部门基于其优势地位对产业的单向介入和渗透,降低了市场准入的真实门槛,同时巨大市场潜力吸引资本无序进入保健食品领域,从而形成多、小、散的产业结构。截至2019年2月底,全国已注册(备案)保健食品批准文号高达15 818个34 ,相比之下日本同类产品仅一千余种。成熟的市场理应竞争品牌、科技、服务等要素,“政府背书式”审批则将其异化为批准文号及其背后利益关系的竞争,非但没有培育出优胜劣汰的良性市场,反而逆向激励了具有自律和守法意识的市场主体。加之《直销管理条例》仅允许保健食品作为功能性食品进入直销领域,这就加剧了批准文号的稀缺性。图1反映了1996年至今我国保健食品批准文号变化情况。可以看到,在涉及国务院机构改革和重要法规出台的1997年、2004年、2008年、2013年,批准文号数量都较上一年度显著增加,两方面拟合度极高,并成为整体趋势的重要拐点。尽管个中原因复杂,但“政府背书式”审批制度并未有效控制市场准入,制度变革反而带来批准文号的周期性波峰(命题1)。
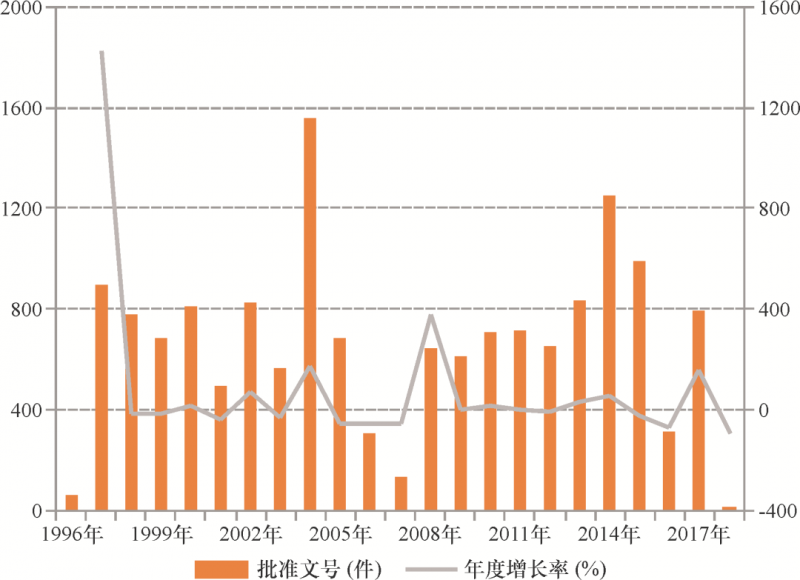
图1 全国保健食品批准文号数量和年度增长率(1996—2017年)注: 感谢中国保健协会保健品市场工作委员会提供2007年及之前数据,2008年及之后数据根据原国家食品药品 ;监督管理(总)局公布的历年《食品药品监管统计年报》(http://www.nmpa.gov.cn/WS04/CL2151/),经作者整理。
(二)行政扭曲市场:过度管控难以防范过程性风险
理想的食品安全监管模式,是基于风险分析框架的科学决策和执行35 。政府近年来倡导的“双随机、一公开”、重点监管、信用监管,都是建立在风险研判基础上的新型监管机制,区别于传统的线性监管模式。“政府背书式”审批弱化了生产经营者主体责任,在市场规模持续扩张中加剧行业普遍性违法违规。为防范生产经营活动的过程性风险,监管部门的初衷是基于行政思维强化事中事后干预,从而防止利益驱动行为。然而这种以形式要件加大合规难度为特征的过度管控,违背了风险分析原则,有些措施也不直接针对安全性和有效性事项,还忽略了监管政策成本收益分析。其加剧优不胜、劣不汰的竞争扭曲,无法为守法生产经营者提供正向激励,导致政策目标和执行结果相背离。
具体到保健食品生产环节,产品配方、生产工艺、标签命名都存在过度管控。例如辅料用量不涉及产品安全有效,监管部门依然规定了严格的变更申请程序,从而增加企业变更申请的财务和时间成本,并降低其改善内部质量管理的积极性。基于同样的逻辑,生产工艺变更也面临挑战。由于现存保健食品批准文号中有5 076个由原卫生部审批且永久有效,十几年前批准的生产工艺已滞后于国家标准更新和生产设备升级。然而监管部门出于对产品安全性和功效的忧虑,对生产工艺变更持保守态度,规定了复杂文献依据和试验数据要求,并且不愿把权力下放给信息更为充分的省级监管部门。于是,一些企业在侥幸心理下擅自变更生产工艺。过去情况类似的制药行业数据佐证了这一假设:中国医药企业管理协会对全国近百家药品生产企业的调研表明,样本中超过八成的企业进行过生产工艺变更,但申请流程较长和耗资巨大,其中有高达77.59%的企业存在未按照规定擅自完成变更生产工艺补充申请的情况36 。标签命名更具有戏剧性。由于监管部门担忧保健食品商品名误导消费者,从最初的不允许夸大命名,到后来允许保健功能命名,再到不允许保健功能命名,最后只能采用原料简称或原料全称命名,甚至对包装盒上的文字大小作出具体规定,复杂的科学术语反而加剧了消费者的理解难度,使得产品高度同质化,不利于功能宣称信息的准确传递。
经营环节同样遭遇过度管控。我国保健食品经营企业多、小、散,不同渠道销售额占比分别为直销40%、会议销售20%、电商15%、药店10%、其他(包括呼叫中心、微商、专营店、专业推广)15%37 。产业素质偏低放大了功能声称被虚假宣传的概率,因此监管部门最初仅允许12种功能声称,后几经扩容达到27种功能声称。即便如此依然与发达国家差异巨大,如澳大利亚的辅助药品允许1 013种功能宣称和5 000多种原料。2019年3月,监管部门试图调整和取消部分功能声称,从而进一步缩小声称范围和降低声称强度38 。保守思维下的有限功能目录带来诸多弊端。一方面研发型企业创新被抑制,难以满足人民群众日益增长的高质量消费需求。全部获批产品中具有增强免疫力、缓解体力疲劳、辅助降血脂和补充维生素、补钙功能声称的约占76.9%39 ,产品低水平重复严重。另一方面,功能声称短缺客观上限制了消费者教育空间,加剧保健食品市场信息不对称,逆向激励会议销售企业虚假宣传的行为动机。基于数据可及性,研究统计了2012年至2017年全国保健食品生产企业违规操作率和经营环节产品不合格率,其代表监管部门事中事后监管力度,两者均呈现总体下降趋势,2014年以后维持在2%—1%的低位。与之相反,来自消费者的保健食品投诉举报数量则不断上升,主要涉及虚假宣传及虚假广告(图2)。换言之,监管部门获取的企业行为和产品安全数据持续好转,并不能反映保健食品市场真实风险的变化情况,工作重点与关键风险点不一致,两者形成明显的“剪刀差”。
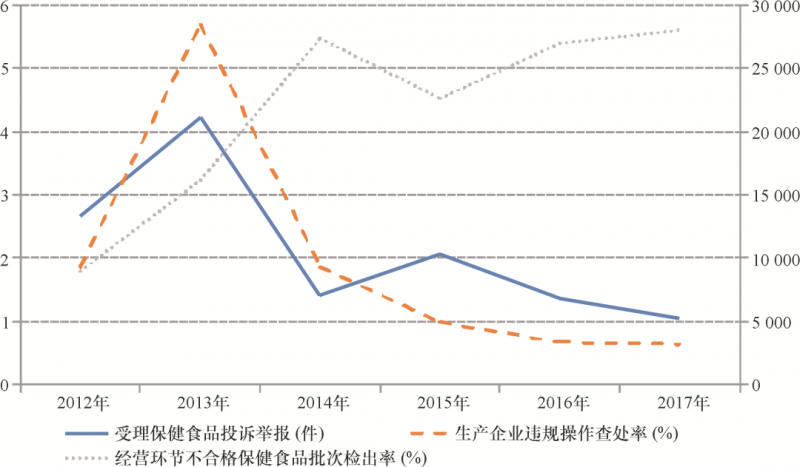
图2 全国保健食品安全状况主要指标(2012—2017年)注:国家食品药品监督管理总局信息中心编写的历年《食品药品监督管理统计年鉴》,经作者整理。
当过度管控嵌入“碎片化”监管体制时,其挑战更为严峻。不同部门基于自身职能设置政策议程和目标,既叠加了过度管控的政策效应,又未能针对全生命周期风险构建制度合力,从而形成不协同甚或相冲突的政策体系。例如,直销是保健食品市场最大的销售渠道,作为直销牌照发证主体的商务部依据《直销管理条例》仅允许单层次直销,工商行政部门和公安机关则在日常监管中依据最高人民法院、最高人民检察院、公安部联合印发的《关于传销最适用法律问题的意见》默认三层次直销,从而给执法办案带来巨大自由裁量空间。又如,随着跨境电商日益受消费者青睐,财政、海关、市场监管等部门政策目标出现微妙差异。不论是2017年国务院食安办牵头9部门开展的食品、保健食品欺诈和虚假宣传整治,还是2019年国家市场监管总局等13部门联合开展的整治“保健”市场乱象百日行动,都是监管者试图化解分割体系的尝试。然而,统筹协调的制度设计往往异化为权责模糊时的被动兜底,监管空白地带长期存在。加之2003年、2008年、2018年三轮机构改革,保健食品审批和监管职能先后从原卫生部划转原国家食品药品监督管理(总)局,后又移交国家市场监督管理总局,体制的反复变迁导致政策缺乏连续性和一致性。归纳而言,过度管控无法有效防范过程性风险(命题2)。
(三)行政庇护市场:事权“剩余化”下沉和运动整治
随着准入门槛偏低和生产经营过程性风险放大,保健食品市场虚假宣传、违规直销和传销、危害食品安全等失灵现象频繁发生。例如在“保健”市场整治百日行动中,仅从2019年1月8日至3月10日,全国共立案6 535件,结案2 290件,案值77.9亿元,罚没金额2.68亿元,移送司法机关案件174件40 。尤其随着社会主要矛盾转化,“保健”市场乱象容易引发社会不稳定乃至政治风险。尽管我们承认,中央政府承担全国性公共产品的供给责任是有效率的。因此即便在美国,联邦监管机构主导了涉及国家利益和市场要素自由流动的行政事务,包括提供膳食补充剂监管服务。中国的经验事实则不同,为转移责任和分散风险,同时法律通常对监管事权纵向划分仅作模糊的原则性规定,上级监管部门倾向于向地方过度分权41 。决策者曾提出多级责任结构的事权划分原则:产品上市审批以国家为主,生产企业行政许可、体系核查、日常监管以省级为主,点多面广的经营企业抽检和日常检查以市县为主。其出发点是发挥各级监管部门的比较优势,但客观上造成监管事权“剩余化”下沉:地方政府对本行政区域监管工作负总体责任,并在职责不清时兜底性地承担综合协调和风险化解责任42 。
在压力型体制下,监管权责向下但行政资源向上,专业监管能力缺失导致监管力度层层衰减。据统计,各级地方政府部门批准的各类“食字号”“健字号”相关产品高达5万多种,而实际上地方并没有审批保健食品的权限。企业利用政策漏洞和消费者认知缺陷,大肆生产销售概念模糊的“保健品”43 。市场监管总局于2019年1月公布的“保健”市场乱象14个典型案例中,真正涉及正规保健食品的仅一例,其余均是以“保健”名义开展的各类违法违规行为。概念混淆带来污名化问题,进一步恶化了保健食品产业的生存环境。随着公共事件频发,上级监管部门以运动整治回应社会舆论压力,并动员地方加大监督执法力度,但未改变能力与权责不匹配的本质。
作者统计了上述百日行动中13个督导组赴全国23个省级行政区域开展督导情况,行业龙头企业安利在各地的机构和销售网点被督导组检查12次,无限极被检查5次,在所有生产经营者中频次最高。而实证研究通过对美国制药企业违规操作影响因素的分析,发现企业规模越大其违规操作的概率越低44 。可见,现有运动整治模式耗费了大量行政资源。与此同时,由于保健食品行政许可资料由省级以上监管部门掌握,基层对相关信息既不可及也不理解,只能机械地执行任务并“一刀切”地开展监管执法,无法通过专业监管行为精准地化解风险,反而让守法企业成本高企。例如有地方要求“会议营销”企业在上述百日行动期间不得营业,也有地方将“卫健字号”产品从药店下架,等等。尽管其有助于短期内震慑违法行为,却没有形成市场退出的有效机制,尤其是对“游击式”非法会销企业办法不多,客观上庇护了低水平生产经营者和落后产能。因此从产业结构的角度来看,运动整治未能提升低水平保健食品市场。根据表2的归纳,我们看到在近乎周期性的整治中,参与部门愈来愈多,执法人员、立案件数、罚没金额、移送司法等数据总体亦呈上升趋势,然而营养补充剂前三品牌市场集中度(MCR3)不升反降(命题3)。
表2 保健食品行业主要运动整治(2013年至今)
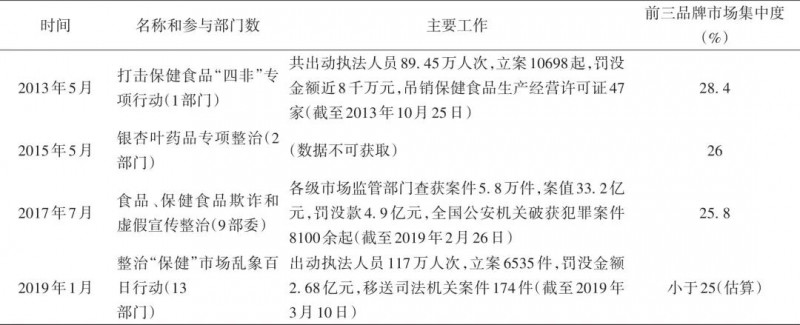
注: 感谢中国保健协会市场工作委员会提供数据,经作者整理。
五、均衡市场和监管:理论归因和政策建议
在围绕中国市场监管现代化的相关研究中,有一个被忽略的重要问题,即在监管能力总体持续增强的前提下,为何良好的政策意愿往往达不到理想结果,甚至走向初衷的反面?以保健食品为例,本研究提供了监管能力不足之外的补充解释,即“中国式”监管制度独有的行政吸纳市场特征。归纳而言,“政府背书式”审批从制度原点培育出系统性薄弱的产业基础;过度管控的事中事后监管扭曲市场竞争,并放大过程性风险;为应对普遍市场失灵的运动整治并未构建长效机制,最终庇护了低水平市场进入者。西方国家的监管失灵主要表现为监管俘获(capture)和监管套利(arbitrage),其或者源于政府自身的委托代理困境,也可以是市场偏好显示问题和集体行动的非逻辑性。“中国式”监管型国家的经验事实则不能完全被西方理论解释,在行政吸纳市场的关系中,最严监管的政策意愿和行动会带来事与愿违的结果,这是由政府与市场关系中的行政主导理念、非均衡结构和单向介入决定的。
研究在微观层面对保健食品监管制度中的市场准入、过程控制、专项整治三个环节进行历史梳理和实证分析,发现保健食品领域问题不能单纯归因于市场主体利益驱动,也不完全是监管缺位,而正是行政吸纳市场带来的制度困境。首先,由于保健食品功能边界模糊和法律定位缺失,监管部门在全能主义制度惯性下建立起严格审批的市场准入制度,试图培育市场秩序促进产业良性发展。然而受监管能力硬性约束,政策宽松执行和企业寻租泛滥,进而形成低门槛的“政府背书式”审批。其次,人口老龄化和消费全面升级引导资本进入,保健食品产业基础薄弱但产业规模持续扩大。为防范市场活动过程性风险,过度管控既增加了企业制度性交易成本,又扭曲了优胜劣汰的市场竞争。尤其是监管体制“碎片化”与产业结构多、小、散形成矛盾,放大了过度管控弊端。而后,消费者教育和社会共治不足加剧信息不对称,虚假宣传、违规直销等市场失灵泛滥。这类问题容易引发社会矛盾,进而对监管部门行为形成逆向激励:一方面采取更加保守的市场准入制度,另一方面更加依赖运动整治但非提升监管能力长效机制。随着上述机理的循环反复,出现低水平市场进入者被庇护和高质量供给被抑制并存的局面,产业愈发依附于监管,其学理逻辑如图3所示。
在围绕中国市场监管现代化的相关研究中,有一个被忽略的重要问题,即在监管能力总体持续增强的前提下,为何良好的政策意愿往往达不到理想结果,甚至走向初衷的反面?以保健食品为例,本研究提供了监管能力不足之外的补充解释,即“中国式”监管制度独有的行政吸纳市场特征。归纳而言,“政府背书式”审批从制度原点培育出系统性薄弱的产业基础;过度管控的事中事后监管扭曲市场竞争,并放大过程性风险;为应对普遍市场失灵的运动整治并未构建长效机制,最终庇护了低水平市场进入者。西方国家的监管失灵主要表现为监管俘获(capture)和监管套利(arbitrage),其或者源于政府自身的委托代理困境,也可以是市场偏好显示问题和集体行动的非逻辑性。“中国式”监管型国家的经验事实则不能完全被西方理论解释,在行政吸纳市场的关系中,最严监管的政策意愿和行动会带来事与愿违的结果,这是由政府与市场关系中的行政主导理念、非均衡结构和单向介入决定的。
研究在微观层面对保健食品监管制度中的市场准入、过程控制、专项整治三个环节进行历史梳理和实证分析,发现保健食品领域问题不能单纯归因于市场主体利益驱动,也不完全是监管缺位,而正是行政吸纳市场带来的制度困境。首先,由于保健食品功能边界模糊和法律定位缺失,监管部门在全能主义制度惯性下建立起严格审批的市场准入制度,试图培育市场秩序促进产业良性发展。然而受监管能力硬性约束,政策宽松执行和企业寻租泛滥,进而形成低门槛的“政府背书式”审批。其次,人口老龄化和消费全面升级引导资本进入,保健食品产业基础薄弱但产业规模持续扩大。为防范市场活动过程性风险,过度管控既增加了企业制度性交易成本,又扭曲了优胜劣汰的市场竞争。尤其是监管体制“碎片化”与产业结构多、小、散形成矛盾,放大了过度管控弊端。而后,消费者教育和社会共治不足加剧信息不对称,虚假宣传、违规直销等市场失灵泛滥。这类问题容易引发社会矛盾,进而对监管部门行为形成逆向激励:一方面采取更加保守的市场准入制度,另一方面更加依赖运动整治但非提升监管能力长效机制。随着上述机理的循环反复,出现低水平市场进入者被庇护和高质量供给被抑制并存的局面,产业愈发依附于监管,其学理逻辑如图3所示。
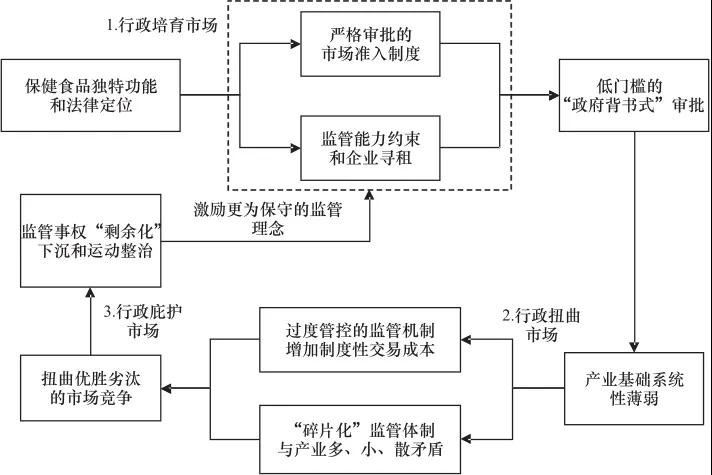
图3 我国保健食品监管制度困境的逻辑
注:作者自制。
发达国家政府旨在通过监管干预和纠正质量安全、虚假宣传等市场失灵,因此监管的本质是补充市场而非替代之,严格监管有利于激励企业守法并震慑违法。其更多依靠内生于市场的竞争机制和司法途径,而不是外加行政干预手段。“中国式”政府监管有其独特性,以“政府背书式”审批、过度管控和监管事权“剩余化”下沉为主要机制的线性监管模式,是行政逻辑对市场机制的全面主导和渗透。可见,培育市场、监管市场、服务市场本身内在关联,其逻辑主线便是尊重市场规律。政府与市场的理想边界不是主观设计出来的,而是长期内生演化的结果。监管制度设计应主动适应产业发展和科技进步,这既是监管科学的题中之义,也是“中国式”保健食品监管带给我们的思考。
不破则不立,应突破行政吸纳市场的困局,坚持放管结合和扶正祛邪,在借鉴国际经验的基础上改革我国保健食品监管制度。一方面要树立市场塑造监管的理念。如果说上世纪90年代中期的“政府背书式”审批有其合理性,如今中国部分保健食品生产企业的规模和技术水平完全可以“自我背书”,市场准入制度应当有根本性变革。可喜的是,2016年起原国家食品药品监督管理总局开展保健食品注册管理制度改革,表示要逐步形成备案是多数、注册审批是少数的监管新格局。在此基础上,建议实行基于风险分析的功能声称分类管理,并扩大功能目录和原料目录。功能声称是连接消费需求和商业利益的桥梁,通过扩大企业自我声称范围落实其主体责任。涉及疾病或人体风险的辅助治疗声称、健康声称需监管部门批准并设置较高科学证据要求,除此之外的结构功能声称和营养素含量声称由企业负责,并交给市场检验。另一方面要树立市场助力监管的理念。原卫生部于2003年4月发布《保健食品良好生产规范审查方法和评价准则》,标志着我国保健食品生产质量管理规范(GMP)的全面实施。然而在现实中,监管资源短缺的约束凸显。应当精简审批职能释放监管资源,在资金、设备等微观要素上少设“路障”,在市场行为规则上多设“路标”,提升事中事后监管有效性倒逼企业主体责任。与此同时,考虑购买专业第三方监管服务的可能性,发挥市场在监管资源配置中的决定性作用。同样重要的是发挥企业在消费者教育中的主体作用,通过提升消费者素养抵制虚假宣传。
注释
1. 林丽鹂:《多部门整治“保健”市场乱象百日行动启动》,《人民日报(海外版)》2019年1月9日。
2. 王金臣:《2018年国家食品安全监督抽检样品平均合格率为97.6%》,《中国食品报》2019年4月2日。
3. 国家食品药品监督管理总局:《2016年度食品药品监管统计年报》,参见http://www.nmpa.gov.cn/WS04/CL2151/329204.html。
4. 国家市场监督管理总局:《多部门联合整治“保健”市场乱象百日行动启动》,参见http://www.gov.cn/xinwen/2019-01/08/content_5355884.htm。
5. 邹谠:《二十世纪中国政治》,香港:牛津大学出版社,1994年,第69页。
6. Majone, Giandomenico. The Rise of the Regulatory State in Europe. West European Politics, 1994, 17 (3).
7. Djankov, S., Glaeser, E. L., Florencio, L. D. S., La Porta, R., & Shleifer, A. The New Comparative Economics. Journal of Comparative Economics, 2003, Vol.31(4).
8. 胡颖廉:《“中国式”市场监管:逻辑起点、理论观点和研究重点》,《中国行政管理》2019年第5期。
9. OECD. Structural Reform and Capacity Building: Proceedings of the Eighth APEC-OECD Workshop on Regulatory Reform. Paris: OECD Publishing, 2008.
10. 徐家良:《新组织形态与关系模式的创建——体制吸纳问题探讨》,《北京大学学报(哲学社会科学版)》2008年第3期。
11. 黄卫平、陈文:《民间政治参与和体制吸纳的互动——对深圳市公民自发政治参与三个案例的解读》,《马克思主义与现实》2006年第3期。
12. 王清:《从权宜之计到行政吸纳:地方政府回应社会方式的转型》,《中国行政管理》2015年第6期。
13. 唐文玉:《行政吸纳服务——中国大陆国家与社会关系的一种新诠释》,《公共管理学报》2010年第1期。
14. 周建国:《行政吸纳服务:农村社会管理新路径分析》,《江苏社会科学》2012年第6期。
15. 康晓光、韩恒:《行政吸纳社会——当前中国大陆国家与社会关系再研究》,《中国社会科学(英文版)》2007年第2期。
16. 陈天祥、应优优:《甄别性吸纳:中国国家与社会关系的新常态》,《中山大学学报(社会科学版)》2018年第2期。
17. 新华社:《习近平对食品安全工作作出重要指示》,参见http://www.xinhuanet.com//politics/2016-01/28/c_1117928490.htm。
18. 刘亚平:《中国式“监管国家”的问题与反思:以食品安全为例》,《政治学研究》2011年第2期。
19. 郁建兴、朱心怡、高翔:《政府职能转变与市场监管治理体系构建的共同演进逻辑——基于疫苗监管治理体系及应对危机事件的案例研究》,《管理世界》2020年第2期。
20. 中国行政管理学会课题组:《平衡监管和市场:疫苗安全的挑战和对策》,《中国行政管理》2018年第10期。
21. 倪星、王锐:《从邀功到避责:基层政府官员行为变化研究》,《政治学研究》2017年第2期。
22. 需要说明的是,我国尚未在法律层面对保健食品进行定义,2005年国家食品药品监督管理局公布施行的《保健食品注册管理办法(试行)》(已于2016年7月1日废止)规定,“保健食品是声称具有特定保健功能或者以补充维生素、矿物质为目的的食品。即适宜于特定人群食用,具有调节机体功能,不以治疗疾病为目的,并且对人体不产生任何急性、亚急性或者慢性危害的食品。”值得注意的是,作为法规和科学概念的保健食品与通俗意义上的“保健”市场容易混淆,后者还包括了宣称具有“保健”功能的器材、用品、用具如床垫、器械、理疗仪、饮水机、频谱仪等,冒充保健食品的压片糖果、固体饮料等普通食品,以及声称具有“保健”功效的服务。
23. 曾宏燕:《上海巨商黄楚九》,北京:人民文学出版社,2004年,第78页。
24. 孙桂菊:《我国保健食品产业发展历程及管理政策概述》,《食品科学技术学报》2018年第2期。
25. 中国保健协会、中国社会科学院食品药品产业发展与监管研究中心:《中国保健食品产业发展报告》,北京:社会科学文献出版社,2012年,第40—57页。
26. 1996年7月,卫生部颁布配套的《保健食品评审技术规程》和《保健食品功能学评价程序和方法》,并规定保健食品的功能评价要在卫生部认定的功能学检测机构进行,实行省级和卫生部两级审批制度。长期以来,由卫生行政部门认定31家功能学评价机构和34家稳定性试验机构,省级监管部门现场核查和抽样送机构检验后,进入技术审评和行政审批环节。2017年10月,《特殊食品验证评价技术机构工作规范》规定,注册或备案相关的产品检验、安全与功能验证和临床试验等验证评价工作的技术机构实施备案管理,从而结束了行政认定的历史。
27. CRN. Who Takes Dietary Supplement? Washington D. C.: Council for Responsible Nutrition, 2018, p3.
28. AC尼尔森:《消费者购买药品/保健品时更重品牌 上海人保健品支出最多》,《商业经理人》2005年第6期。
29. 新华网:《2017年中国保健食品产值约4000亿元》,参见http://www.xinhuanet.com/food/2018-03/29/c_1122607619.htm。
30. 王海磬:《中消协发布〈信用消费与消费者认知调查报告〉消费信心较为充足信用建设仍需加强》,《光明日报》2019年3月16日。
31. Shao, Andrew.A Scientific framework for Foods vs. Drugs: The New Paradigm of Evidence-based Nutrition. London: IADSA Scientific Council, 2017, p7.
32. 新华视点:《绿A汤臣倍健等8品牌螺旋藻铅严重超标最高达820%》,参见http://www.ce.cn/cysc/sp/info/201203/28/t20120328_21139799.shtml。
33. 访谈记录:中国保健协会某专家,2019年4月2日上午。
34. 国家市场监督管理总局:《特殊食品信息查询平台》,参见http://tsspxx.gsxt.gov.cn/gcbjp/tsspindex.xhtml。
35. WHO/FAO. Food Safety Risk Analysis: A Guide for National Food Safety Authorities. Rome: FAO Food and Nutrition Paper 87, 2006.
36. 章艺枫:《药品生产工艺变更沉疴待解频繁爆雷背后必须注意这五点》,《E药经理人》2019年第3期。
37. 荆文娜:《保健食品治理:政府“救火式”方法不够用,还应培养成熟的消费者》,《中国经济导报》2017年3月24日。
38. 市场监管总局:《关于征求调整保健食品保健功能意见的公告》,参见http://gkml.samr.gov.cn/nsjg/tssps/201903/t20190328_292435.html。
39. 钟文洁、刘淑聪:《保健食品注册及消费市场现状分析》,《中国药事》2016年第11期。
40. 佘颖:《整治“保健”市场乱象百日行动已立案6535件》,《经济日报》2019年3月15日。
41. 曹正汉、周杰:《社会风险与地方分权:中国食品安全监管实行地方分级管理的原因》,《社会学研究》2013年第1期。
42. 胡颖廉:《剩余监管权的逻辑和困境——基于食品安全监管体制的分析》,《江海学刊》2018年第2期。
43. 刘霞、孙璐:《“保健”热点追踪研究之三:拨云见日看“保健”》,参见http://www.ce.cn/cysc/zljd/qwfb/201902/13/t20190213_31466275.shtml。
44. Olson, Mary. Substitution in Regulatory Agencies: FDA Enforcement Alternatives. Journal of Law, Economics, and Organization, 1996 (2).
不破则不立,应突破行政吸纳市场的困局,坚持放管结合和扶正祛邪,在借鉴国际经验的基础上改革我国保健食品监管制度。一方面要树立市场塑造监管的理念。如果说上世纪90年代中期的“政府背书式”审批有其合理性,如今中国部分保健食品生产企业的规模和技术水平完全可以“自我背书”,市场准入制度应当有根本性变革。可喜的是,2016年起原国家食品药品监督管理总局开展保健食品注册管理制度改革,表示要逐步形成备案是多数、注册审批是少数的监管新格局。在此基础上,建议实行基于风险分析的功能声称分类管理,并扩大功能目录和原料目录。功能声称是连接消费需求和商业利益的桥梁,通过扩大企业自我声称范围落实其主体责任。涉及疾病或人体风险的辅助治疗声称、健康声称需监管部门批准并设置较高科学证据要求,除此之外的结构功能声称和营养素含量声称由企业负责,并交给市场检验。另一方面要树立市场助力监管的理念。原卫生部于2003年4月发布《保健食品良好生产规范审查方法和评价准则》,标志着我国保健食品生产质量管理规范(GMP)的全面实施。然而在现实中,监管资源短缺的约束凸显。应当精简审批职能释放监管资源,在资金、设备等微观要素上少设“路障”,在市场行为规则上多设“路标”,提升事中事后监管有效性倒逼企业主体责任。与此同时,考虑购买专业第三方监管服务的可能性,发挥市场在监管资源配置中的决定性作用。同样重要的是发挥企业在消费者教育中的主体作用,通过提升消费者素养抵制虚假宣传。
注释
1. 林丽鹂:《多部门整治“保健”市场乱象百日行动启动》,《人民日报(海外版)》2019年1月9日。
2. 王金臣:《2018年国家食品安全监督抽检样品平均合格率为97.6%》,《中国食品报》2019年4月2日。
3. 国家食品药品监督管理总局:《2016年度食品药品监管统计年报》,参见http://www.nmpa.gov.cn/WS04/CL2151/329204.html。
4. 国家市场监督管理总局:《多部门联合整治“保健”市场乱象百日行动启动》,参见http://www.gov.cn/xinwen/2019-01/08/content_5355884.htm。
5. 邹谠:《二十世纪中国政治》,香港:牛津大学出版社,1994年,第69页。
6. Majone, Giandomenico. The Rise of the Regulatory State in Europe. West European Politics, 1994, 17 (3).
7. Djankov, S., Glaeser, E. L., Florencio, L. D. S., La Porta, R., & Shleifer, A. The New Comparative Economics. Journal of Comparative Economics, 2003, Vol.31(4).
8. 胡颖廉:《“中国式”市场监管:逻辑起点、理论观点和研究重点》,《中国行政管理》2019年第5期。
9. OECD. Structural Reform and Capacity Building: Proceedings of the Eighth APEC-OECD Workshop on Regulatory Reform. Paris: OECD Publishing, 2008.
10. 徐家良:《新组织形态与关系模式的创建——体制吸纳问题探讨》,《北京大学学报(哲学社会科学版)》2008年第3期。
11. 黄卫平、陈文:《民间政治参与和体制吸纳的互动——对深圳市公民自发政治参与三个案例的解读》,《马克思主义与现实》2006年第3期。
12. 王清:《从权宜之计到行政吸纳:地方政府回应社会方式的转型》,《中国行政管理》2015年第6期。
13. 唐文玉:《行政吸纳服务——中国大陆国家与社会关系的一种新诠释》,《公共管理学报》2010年第1期。
14. 周建国:《行政吸纳服务:农村社会管理新路径分析》,《江苏社会科学》2012年第6期。
15. 康晓光、韩恒:《行政吸纳社会——当前中国大陆国家与社会关系再研究》,《中国社会科学(英文版)》2007年第2期。
16. 陈天祥、应优优:《甄别性吸纳:中国国家与社会关系的新常态》,《中山大学学报(社会科学版)》2018年第2期。
17. 新华社:《习近平对食品安全工作作出重要指示》,参见http://www.xinhuanet.com//politics/2016-01/28/c_1117928490.htm。
18. 刘亚平:《中国式“监管国家”的问题与反思:以食品安全为例》,《政治学研究》2011年第2期。
19. 郁建兴、朱心怡、高翔:《政府职能转变与市场监管治理体系构建的共同演进逻辑——基于疫苗监管治理体系及应对危机事件的案例研究》,《管理世界》2020年第2期。
20. 中国行政管理学会课题组:《平衡监管和市场:疫苗安全的挑战和对策》,《中国行政管理》2018年第10期。
21. 倪星、王锐:《从邀功到避责:基层政府官员行为变化研究》,《政治学研究》2017年第2期。
22. 需要说明的是,我国尚未在法律层面对保健食品进行定义,2005年国家食品药品监督管理局公布施行的《保健食品注册管理办法(试行)》(已于2016年7月1日废止)规定,“保健食品是声称具有特定保健功能或者以补充维生素、矿物质为目的的食品。即适宜于特定人群食用,具有调节机体功能,不以治疗疾病为目的,并且对人体不产生任何急性、亚急性或者慢性危害的食品。”值得注意的是,作为法规和科学概念的保健食品与通俗意义上的“保健”市场容易混淆,后者还包括了宣称具有“保健”功能的器材、用品、用具如床垫、器械、理疗仪、饮水机、频谱仪等,冒充保健食品的压片糖果、固体饮料等普通食品,以及声称具有“保健”功效的服务。
23. 曾宏燕:《上海巨商黄楚九》,北京:人民文学出版社,2004年,第78页。
24. 孙桂菊:《我国保健食品产业发展历程及管理政策概述》,《食品科学技术学报》2018年第2期。
25. 中国保健协会、中国社会科学院食品药品产业发展与监管研究中心:《中国保健食品产业发展报告》,北京:社会科学文献出版社,2012年,第40—57页。
26. 1996年7月,卫生部颁布配套的《保健食品评审技术规程》和《保健食品功能学评价程序和方法》,并规定保健食品的功能评价要在卫生部认定的功能学检测机构进行,实行省级和卫生部两级审批制度。长期以来,由卫生行政部门认定31家功能学评价机构和34家稳定性试验机构,省级监管部门现场核查和抽样送机构检验后,进入技术审评和行政审批环节。2017年10月,《特殊食品验证评价技术机构工作规范》规定,注册或备案相关的产品检验、安全与功能验证和临床试验等验证评价工作的技术机构实施备案管理,从而结束了行政认定的历史。
27. CRN. Who Takes Dietary Supplement? Washington D. C.: Council for Responsible Nutrition, 2018, p3.
28. AC尼尔森:《消费者购买药品/保健品时更重品牌 上海人保健品支出最多》,《商业经理人》2005年第6期。
29. 新华网:《2017年中国保健食品产值约4000亿元》,参见http://www.xinhuanet.com/food/2018-03/29/c_1122607619.htm。
30. 王海磬:《中消协发布〈信用消费与消费者认知调查报告〉消费信心较为充足信用建设仍需加强》,《光明日报》2019年3月16日。
31. Shao, Andrew.A Scientific framework for Foods vs. Drugs: The New Paradigm of Evidence-based Nutrition. London: IADSA Scientific Council, 2017, p7.
32. 新华视点:《绿A汤臣倍健等8品牌螺旋藻铅严重超标最高达820%》,参见http://www.ce.cn/cysc/sp/info/201203/28/t20120328_21139799.shtml。
33. 访谈记录:中国保健协会某专家,2019年4月2日上午。
34. 国家市场监督管理总局:《特殊食品信息查询平台》,参见http://tsspxx.gsxt.gov.cn/gcbjp/tsspindex.xhtml。
35. WHO/FAO. Food Safety Risk Analysis: A Guide for National Food Safety Authorities. Rome: FAO Food and Nutrition Paper 87, 2006.
36. 章艺枫:《药品生产工艺变更沉疴待解频繁爆雷背后必须注意这五点》,《E药经理人》2019年第3期。
37. 荆文娜:《保健食品治理:政府“救火式”方法不够用,还应培养成熟的消费者》,《中国经济导报》2017年3月24日。
38. 市场监管总局:《关于征求调整保健食品保健功能意见的公告》,参见http://gkml.samr.gov.cn/nsjg/tssps/201903/t20190328_292435.html。
39. 钟文洁、刘淑聪:《保健食品注册及消费市场现状分析》,《中国药事》2016年第11期。
40. 佘颖:《整治“保健”市场乱象百日行动已立案6535件》,《经济日报》2019年3月15日。
41. 曹正汉、周杰:《社会风险与地方分权:中国食品安全监管实行地方分级管理的原因》,《社会学研究》2013年第1期。
42. 胡颖廉:《剩余监管权的逻辑和困境——基于食品安全监管体制的分析》,《江海学刊》2018年第2期。
43. 刘霞、孙璐:《“保健”热点追踪研究之三:拨云见日看“保健”》,参见http://www.ce.cn/cysc/zljd/qwfb/201902/13/t20190213_31466275.shtml。
44. Olson, Mary. Substitution in Regulatory Agencies: FDA Enforcement Alternatives. Journal of Law, Economics, and Organization, 1996 (2).

